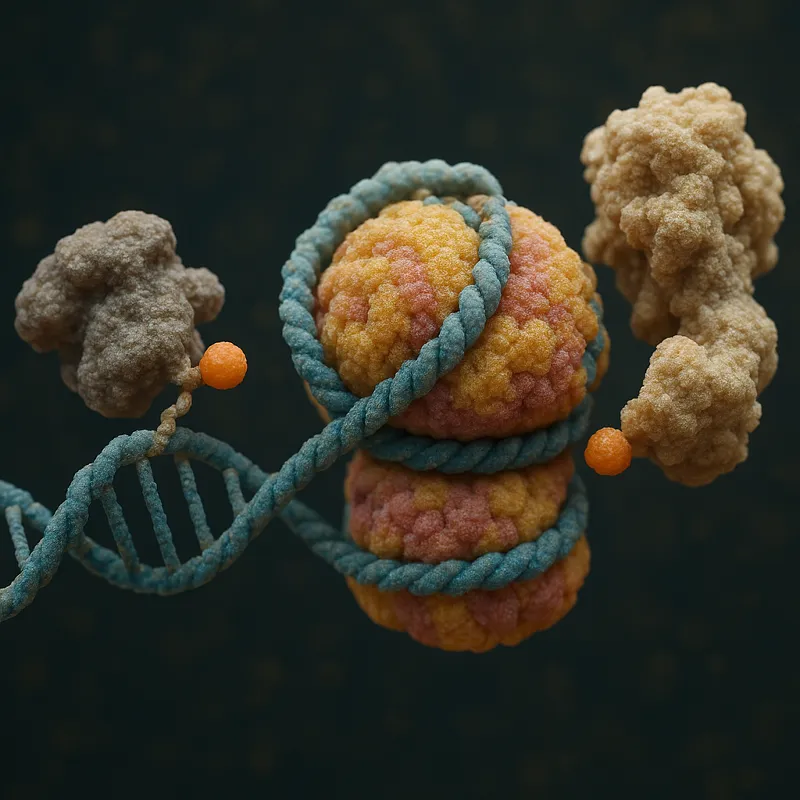
Einführung in die Histon-Deacetylasen
Histon-Deacetylasen (HDACs) sind Enzyme, die Acetylgruppen von lysinreichen Histonproteinen entfernen. Diese Modifikation beeinflusst die Chromatinstruktur und damit die Genexpression. HDACs spielen eine entscheidende Rolle in der Genregulation und sind an vielen biologischen Prozessen beteiligt, darunter Zellwachstum, Differenzierung und Apoptose. Abnorme HDAC-Aktivitäten sind mit verschiedenen Krankheiten, einschließlich Krebs, verbunden, was sie zu einem wichtigen Ziel für therapeutische Interventionen macht.
👉 Meinen Gesundheitswert prüfen
Mechanismus der HDAC-Regulation
Der Mechanismus der HDAC-Regulation ist komplex und umfasst verschiedene Ebenen der Kontrolle. Dazu gehören posttranslationale Modifikationen, Protein-Protein-Interaktionen und die Rekrutierung zu spezifischen Genomabschnitten. Ein bemerkenswerter Aspekt der HDAC-Regulation ist die Wechselwirkung mit Co-Repressoren, die die Deacetylase-Aktivität modulieren. Beispielsweise bilden HDACs in Verbindung mit NuRD-Komplexen eine Plattform für die Transkriptionsunterdrückung. Solche Interaktionen sind entscheidend für die präzise Kontrolle der Genexpression.
Posttranslationale Modifikationen
Posttranslationale Modifikationen wie Phosphorylierung, Ubiquitinierung und SUMOylierung beeinflussen die Stabilität und Funktion von HDACs. Phosphorylierung kann die enzymatische Aktivität von HDACs entweder fördern oder hemmen, je nach spezifischem HDAC-Typ und Zellkontext. Untersuchungen zeigen, dass die Phosphorylierung an spezifischen Serin- und Threoninresten die Deacetylase-Aktivität reguliert und somit die Genexpression beeinflusst.
Die biologische Grundlage der epigenetischen Uhr 👆HDACs in der Krebsforschung
In der Krebsforschung sind HDACs von großem Interesse, da sie oft überexprimiert sind und zur Tumorprogression beitragen. Besondere Aufmerksamkeit gilt HDAC1, HDAC2 und HDAC3, die in verschiedenen Krebserkrankungen wie Darm-, Brust- und Prostatakrebs eine Rolle spielen. Studien haben gezeigt, dass die Hemmung dieser Enzyme das Tumorwachstum verlangsamen und die Sensitivität gegenüber Chemotherapeutika erhöhen kann. Ein Beispiel ist Vorinostat, ein HDAC-Inhibitor, der zur Behandlung des kutanen T-Zell-Lymphoms eingesetzt wird.
Vorinostat als HDAC-Inhibitor
Vorinostat, auch bekannt als SAHA, ist ein zugelassener HDAC-Inhibitor, der die Acetylierung von Histonen erhöht und die Expression tumorsuppressiver Gene fördert. Klinische Studien haben gezeigt, dass Vorinostat das Überleben von Patienten mit kutanem T-Zell-Lymphom signifikant verbessern kann. Die molekulare Wirkung von Vorinostat umfasst die Induktion von Zellzyklusarrest und Apoptose in Krebszellen, was seine Wirksamkeit als antineoplastisches Mittel unterstreicht.
Histon-Deacetylase-Inhibitoren als Krebsbekämpfungsmechanismus 👆Epigenetische Therapien
Epigenetische Therapien zielen darauf ab, die aberrante Genexpression durch Modulation von HDAC-Aktivitäten zu korrigieren. Diese Behandlungsstrategie ist besonders in der Onkologie vielversprechend, da sie gezielt die epigenetischen Veränderungen in Tumorzellen adressiert. HDAC-Inhibitoren sind eine der Hauptklassen von Medikamenten in diesem Bereich. Ihre Fähigkeit, die chromatinassoziierte Genexpression zu modulieren, macht sie zu einem wertvollen Werkzeug in der personalisierten Krebstherapie.
Zukunftsperspektiven der HDAC-Inhibitoren
Die Entwicklung von HDAC-Inhibitoren hat in den letzten Jahren erhebliche Fortschritte gemacht, wobei neue Verbindungen mit erhöhter Spezifität und geringeren Nebenwirkungen erforscht werden. Die Kombination von HDAC-Inhibitoren mit anderen therapeutischen Ansätzen, wie Immuntherapien, bietet vielversprechende Möglichkeiten zur Verbesserung der Behandlungsergebnisse. Zukünftige Forschungen konzentrieren sich auf die Identifizierung von Biomarkern, die die Auswahl von Patienten für HDAC-Inhibitor-Therapien optimieren könnten.
Verwendung von epigenetischem Marking zur Zelllinienverfolgung 👆HDACs und neurologische Störungen
Neben der Onkologie sind HDACs auch in der Neurologie von Bedeutung. Studien haben gezeigt, dass eine Dysregulation von HDACs mit neurodegenerativen Erkrankungen wie Alzheimer und Parkinson verbunden ist. HDAC-Inhibitoren zeigen in präklinischen Modellen neuroprotektive Wirkungen und verbessern kognitive Funktionen. Dieser Bereich der Forschung bietet neue Hoffnung für die Entwicklung von Behandlungen, die den Verlauf neurologischer Störungen verlangsamen oder umkehren können.
HDACs in neurodegenerativen Erkrankungen
In neurodegenerativen Erkrankungen tragen HDACs zur Fehlregulation der Genexpression bei, die für die neuronale Funktion entscheidend ist. Die Inhibition spezifischer HDACs hat in Tiermodellen die Aggregation pathologischer Proteine reduziert und die synaptische Plastizität verbessert. Diese Erkenntnisse unterstützen die Hypothese, dass HDAC-Inhibitoren potenziell therapeutische Wirkungen bei Alzheimer, Huntington und anderen neurodegenerativen Erkrankungen entfalten können.
FAQ zu Histon-Deacetylasen
Was sind Histon-Deacetylasen?
Histon-Deacetylasen (HDACs) sind Enzyme, die Acetylgruppen von Histonproteinen entfernen und dadurch die Chromatinstruktur und Genexpression beeinflussen.
Warum sind HDACs in der Krebsforschung wichtig?
HDACs sind oft in Krebszellen überexprimiert und tragen zur Tumorprogression bei. HDAC-Inhibitoren können das Tumorwachstum hemmen und die Wirksamkeit von Chemotherapeutika verbessern.
Welche Rolle spielen HDACs in der Neurologie?
HDACs sind bei neurodegenerativen Erkrankungen dysreguliert. HDAC-Inhibitoren haben in präklinischen Studien neuroprotektive Effekte gezeigt und könnten zur Behandlung solcher Erkrankungen beitragen.
Was sind die Herausforderungen bei der Entwicklung von HDAC-Inhibitoren?
Eine der Herausforderungen besteht darin, spezifische HDAC-Inhibitoren zu entwickeln, die effektiv sind und minimale Nebenwirkungen haben. Die Identifizierung geeigneter Biomarker für die Patientenauswahl ist ebenfalls entscheidend.
Wie funktioniert Vorinostat?
Vorinostat ist ein HDAC-Inhibitor, der die Acetylierung von Histonen erhöht, was zur Reaktivierung tumorsuppressiver Gene führt und das Wachstum von Krebszellen hemmt.
Histon-Deacetylase-Inhibitoren als Krebsbekämpfungsmechanismus
Tiefer Blutdruck? Diese Methode hilft sofort!
Fisch in der Schwangerschaft: Die große Liste!
Epigenetische Marker des Alterns in der Genexpression 👆
Facharzt für Innere Medizin · Charité Berlin · Prävention · Ganzheitliche Betreuung
[…] Regulation der Expression von Histon-Deacetylasen […]