Einführung in HIF-1α
HIF-1α, oder der hypoxieinduzierbare Faktor 1-alpha, ist ein Transkriptionsfaktor, der eine zentrale Rolle in der zellulären Antwort auf Sauerstoffmangel, auch Hypoxie genannt, spielt. Dieser Faktor ist besonders relevant in der Krebsforschung, da Tumorzellen häufig in hypoxischen Umgebungen gedeihen. Die Regulation von HIF-1α erfolgt auf verschiedenen Ebenen, darunter Proteinstabilität, Transkriptionsaktivierung und posttranslationalen Modifikationen.
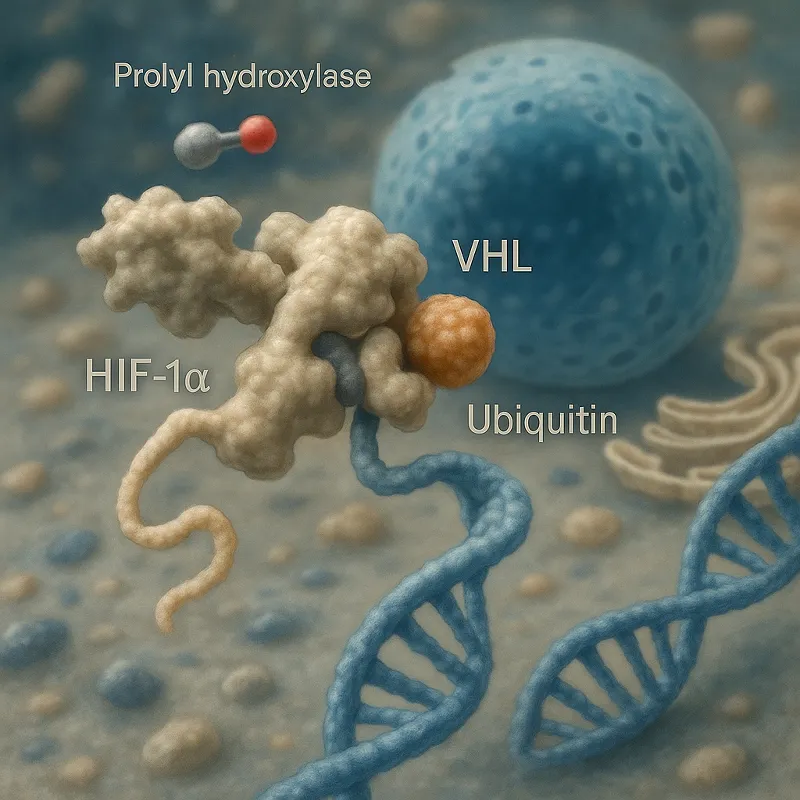
Unter normalen Sauerstoffbedingungen wird HIF-1α durch Prolylhydroxylasen hydroxiliert, was eine Erkennung durch das von Hippel-Lindau (VHL) Tumorsuppressorprotein ermöglicht und zu seinem Abbau durch das Ubiquitin-Proteasom-System führt. Bei Hypoxie wird dieser Abbauweg unterdrückt, was zur Akkumulation von HIF-1α führt und die Expression von Genen aktiviert, die an der Anpassung an niedrigen Sauerstoff beteiligt sind. Dazu gehören Gene, die die Angiogenese, den Glukosestoffwechsel und die Erythropoese regulieren.
👉 Meinen Gesundheitswert prüfen
Regulationsmechanismen
Die Regulation von HIF-1α ist durch eine komplexe Interaktion von molekularen Signalen charakterisiert. In normalen Sauerstoffbedingungen (Normoxie) wird HIF-1α durch die Hydroxylierung von spezifischen Prolylresten markiert, was die Bindung an das VHL-Protein erleichtert und seinen proteasomalen Abbau einleitet. Dies ist ein entscheidender Mechanismus, um die Aktivität von HIF-1α unter Kontrolle zu halten.
Unter hypoxischen Bedingungen hingegen ist die Aktivität der Prolylhydroxylasen gehemmt, was die Stabilität von HIF-1α erhöht. Darüber hinaus spielt die Acetylierung von HIF-1α eine Rolle bei der Regulation seiner Aktivität, indem sie dessen Bindungsaffinität zu Koaktivatoren beeinflusst. Diese Mechanismen zeigen, wie Zellen auf unterschiedliche Sauerstoffverfügbarkeiten reagieren und ihre physiologischen Prozesse entsprechend anpassen.
Hydroxylierung und VHL
Die Hydroxylierung von HIF-1α ist ein biochemischer Prozess, bei dem spezifische Prolinreste in der ODD-Domäne (oxygen-dependent degradation domain) von Prolylhydroxylasen modifiziert werden. Dieser Prozess ist sauerstoffabhängig und dient als molekulares Signal, das die Interaktion mit dem VHL-E3-Ligase-Komplex ermöglicht. Dieser Komplex markiert HIF-1α für den Abbau durch das Ubiquitin-Proteasom-System.
Dieser Mechanismus ist von großer Bedeutung, da er sicherstellt, dass HIF-1α nur unter hypoxischen Bedingungen aktiv ist. Die genaue Regulierung dieser Prozesse ist entscheidend für die Zellhomöostase und kann bei Fehlregulation zu Erkrankungen wie Krebs führen.
Die Genspezifität des Transkriptionsfaktors p53 👆HIF-1α in der Krebsbiologie
Eine der bedeutendsten Rollen von HIF-1α ist seine Beteiligung an der Krebsentwicklung und -progression. In vielen Tumoren wird HIF-1α überexprimiert, was auf eine Anpassung an die hypoxischen Bedingungen innerhalb des Tumorgewebes hinweist. Diese Überexpression korreliert häufig mit einem aggressiveren Tumorverhalten und einer schlechteren Prognose.
HIF-1α fördert die Tumorangiogenese durch die Induktion von VEGF (vascular endothelial growth factor) und andere pro-angiogene Faktoren. Diese Faktoren tragen zur Bildung neuer Blutgefäße bei, die den Tumor mit Sauerstoff und Nährstoffen versorgen. Zudem moduliert HIF-1α den Glukosestoffwechsel, indem es die Glykolyse fördert und die mitochondriale Atmung hemmt, was als “Warburg-Effekt” bekannt ist. Diese metabolische Anpassung ermöglicht es Tumorzellen, in einer sauerstoffarmen Umgebung zu überleben und zu proliferieren.
Fallstudie: Glioblastom
Eine bemerkenswerte Fallstudie, die die Rolle von HIF-1α in der Krebsbiologie illustriert, ist das Glioblastom, eine aggressive Form von Hirntumor. Studien zeigen, dass in Glioblastomen häufig hohe HIF-1α-Spiegel vorhanden sind, die mit einer erhöhten Tumoraggressivität und Resistenz gegenüber Therapien assoziiert sind. Experimente mit Glioblastom-Zelllinien haben gezeigt, dass die Hemmung von HIF-1α die Tumorwachstumsrate vermindern und die Sensitivität gegenüber Strahlentherapie erhöhen kann.
Diese Ergebnisse verdeutlichen die Bedeutung von HIF-1α als therapeutisches Ziel. Die Entwicklung von Inhibitoren, die die Aktivität von HIF-1α spezifisch blockieren können, wird als vielversprechender Ansatz in der Behandlung von hypoxischen Tumoren angesehen.
Die Beziehung zwischen Histonacetylierung und der Aktivierung der Genexpression 👆Therapeutische Ansätze
Die gezielte Beeinflussung der HIF-1α-Signalwege wird als potenzieller Therapieansatz für verschiedene Erkrankungen, insbesondere Krebs, betrachtet. Verschiedene Strategien werden erforscht, um die Aktivität von HIF-1α zu modulieren, darunter die direkte Inhibition der HIF-1α-Dimerisierung, die Beeinflussung der Hydroxylierung sowie die Blockade der nachgeschalteten Zielgene.
Ein Beispiel für einen solchen Ansatz ist die Entwicklung von kleinen Molekülen, die die Bindung der HIF-1α/β-Heterodimerisierung verhindern. Diese Moleküle können die Transkription der Zielgene effektiv reduzieren. Zudem werden Inhibitoren erforscht, die die Funktion der Prolylhydroxylasen beeinflussen, um die Stabilität von HIF-1α zu modulieren. Diese therapeutischen Ansätze zielen darauf ab, die Tumorprogression zu verlangsamen und die Wirksamkeit bestehender Therapien zu verbessern.
Inhibitoren in der Forschung
In der präklinischen Forschung wurden mehrere HIF-1α-Inhibitoren identifiziert, die vielversprechende Ergebnisse zeigen. Eine solche Verbindung ist YC-1, ein Inhibitor, der die Akkumulation von HIF-1α unter hypoxischen Bedingungen verhindert und das Tumorwachstum in Tiermodellen reduziert. Ein weiterer Inhibitor, PX-478, zeigt in klinischen Studien eine Verringerung der HIF-1α-Spiegel und eine verbesserte Sensitivität gegenüber Chemotherapie bei Patienten mit fortgeschrittenen soliden Tumoren.
Diese Studien unterstreichen das Potenzial von HIF-1α-Inhibitoren als innovative Krebsbehandlungen. Dennoch sind weitere Untersuchungen erforderlich, um die Sicherheit, Wirksamkeit und mögliche Nebenwirkungen dieser Verbindungen in der klinischen Anwendung zu bewerten.
Fazit
HIF-1α ist ein zentraler Regulator der zellulären Antwort auf Hypoxie und spielt eine wesentliche Rolle in der Pathophysiologie von Krebs. Seine komplexen Regulationsmechanismen und die Auswirkungen auf verschiedene zelluläre Prozesse machen HIF-1α zu einem attraktiven Ziel für therapeutische Interventionen. Die Forschung auf diesem Gebiet hat das Potenzial, neue Behandlungsmöglichkeiten für hypoxische Tumoren und andere Erkrankungen zu eröffnen, die mit einer gestörten Sauerstoffhomöostase verbunden sind.
Während der Fortschritt vielversprechend ist, bleiben Herausforderungen bestehen, insbesondere in Bezug auf die Entwicklung sicherer und wirksamer Inhibitoren. Zukünftige Studien werden entscheidend sein, um die klinische Relevanz von HIF-1α-gezielten Therapien zu bestätigen und das volle therapeutische Potenzial dieser Ansätze zu realisieren.
Die Phosphorylierung der CTD von RNA-Polymerase II und ihre Verbindung zur Transkriptionsbeendigung 👆FAQ
Was ist HIF-1α?
HIF-1α ist ein Transkriptionsfaktor, der die zelluläre Antwort auf Sauerstoffmangel reguliert und eine wichtige Rolle bei der Anpassung an hypoxische Bedingungen spielt.
Warum ist HIF-1α in der Krebsforschung wichtig?
HIF-1α ist in vielen Tumoren überexprimiert und fördert Prozesse wie Angiogenese und Glykolyse, die das Tumorwachstum unter hypoxischen Bedingungen unterstützen.
Welche therapeutischen Ansätze gibt es zur Beeinflussung von HIF-1α?
Therapeutische Ansätze konzentrieren sich auf die Hemmung der HIF-1α-Aktivität durch Inhibitoren, die die Dimerisierung oder die Genexpression beeinflussen.
Wie wird HIF-1α reguliert?
HIF-1α wird unter normalen Sauerstoffbedingungen durch Hydroxylierung markiert, was zu seinem Abbau führt, während unter hypoxischen Bedingungen diese Hydroxylierung gehemmt wird, was zur Stabilität von HIF-1α beiträgt.
Welche Rolle spielt HIF-1α bei der Hypoxie?
HIF-1α aktiviert die Expression von Genen, die an der Anpassung an niedrige Sauerstoffkonzentrationen beteiligt sind, darunter solche, die die Angiogenese und den Glukosestoffwechsel regulieren.
Mechanismen der Transkriptionsregulation von Enhancer-RNA

Facharzt für Innere Medizin · Charité Berlin · Prävention · Ganzheitliche Betreuung
[…] 관련 글: Die sauerstoffabhängige Expressionsregulation von HIF-1α […]